1. Matière
1.1 Définition
- La matière est le constituant de tout corps qui occupe un espace et possède un poids
1.2 Etats de la matière
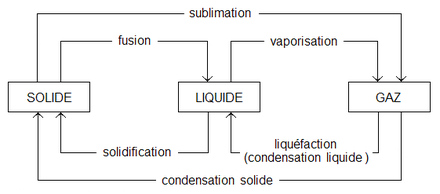
- La matière se présente sous 3 états :
- Etat solide
- Etat liquide
- Etat gazeux
- Le passage de la matière d'un état à un autre est fonction de l'énergie qui permet de modifier la matière
1.3 Composition de la matière
- La matière est composée d'unités de base appelées atomes
2. Atomes
2.1 Définition
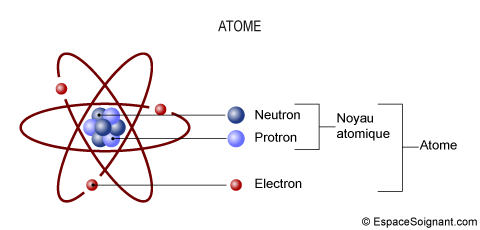
L'atome est la plus petite unité de base de la matière, à l'état électriquement neutre, susceptible d'entrer dans les combinaisons chimiques, c'est-à-dire des molécules.
2.2 Composition
- Un atome a une charge électrique neutre et est composé de 3 sortes de particules élémentaires :
- Noyau : composé de 2 sortes de particules élémentaires, a une charge électrique positive
- Proton (p+) : charge électrique positive (+)
- Neutron (n0) : charge électrique nulle (0)
- Electron (e-) : charge électrique négative (-)
- En orbite autour du noyau
- Noyau : composé de 2 sortes de particules élémentaires, a une charge électrique positive
3. Eléments chimiques
3.1 Définition
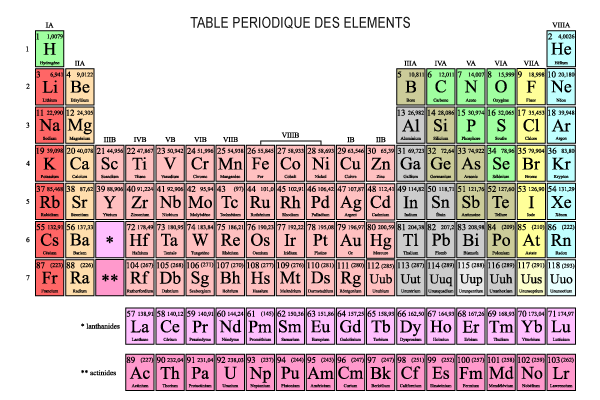
- Un élément est une substance composée d'une seule sorte d'atomes que l'on ne peut pas séparer
- Un élément est donc un atome unique ou des atomes identiques liés chimiquement ensemble
- Il existe 112 éléments :
- 92 éléments naturels
- 20 éléments artificiels
3.1 Identification des éléments
3.1.1 Ecriture symbolique
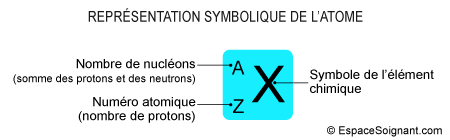
- Les éléments chimiques sont identifiés par 3 critères :
- Numéro atomique :
- Nombre de protons du noyau de l'atome
- Noté Z
- Nombre de masse :
- Somme des masses des protons et des neutrons du noyau
- Noté A
- Masse atomique :
- Moyenne des masses relatives de tous les isotopes (atomes dont le nombre de protons est identique mais dont le nombre des neutrons est différent) d'un élément
- Ecriture symbolique d'un éléments chimiques : AZX
- A : nombre de masse (protons + neutrons)
- Z : numéro atomique (protons)
- X : symbole de l'élément
3.3 Eléments du corps humain
- Oxygène
- 168O
- 65 % de la masse corporelle
- Carbone
- 126C
- 18 % de la masse corporelle
- Hydrogène
- 11H
- 10 % de la masse corporelle
- Azote
- 147N
- 3 % de la masse corporelle
- Calcium
- 40,120Ca
- 1,5 % de la masse corporelle
- Phosphore
- 3115P
- 1 % de la masse corporelle
- Potassium
- 39,119K
- 0,4 % de la masse corporelle
- Soufre
- 32,116S
- 0,3 % de la masse corporelle
- Sodium
- 2311Na
- 0,2 % de la masse corporelle
- Chlore
- 35,517Cl
- 0,2 % de la masse corporelle
- Magnésium
- 24,312Mg
- 0,1 % de la masse corporelle
- Iode
- 126,953I
- 0,1 % de la masse corporelle
- Fer
- 55,826Fe
- 0,1 % de la masse corporelle
- Cuivre
- 63,529Cu
- < 0,01 % de la masse corporelle
- Zinc
- 65,430Zn
- < 0,01 % de la masse corporelle
- Sélénium
- 7934Se
- < 0,01 % de la masse corporelle
- Molybdène
- 95,942Mo
- < 0,01 % de la masse corporelle
- Fluor
- 199F
- < 0,01 % de la masse corporelle
- Manganèse
- AZMn
- < 0,01 % de la masse corporelle
- Cobalt
- 54,925Co
- < 0,01 % de la masse corporelle
- Lithium
- 6,93Li
- < 0,01 % de la masse corporelle
- Silicium
- 28,114Si
- < 0,01 % de la masse corporelle
- Chrome
- 5224Cr
- < 0,01 % de la masse corporelle
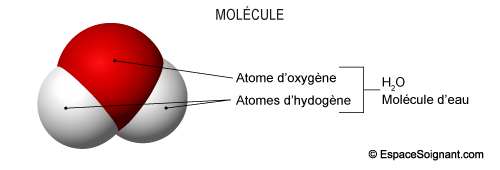
4. Molécules
4.1 Définition
Une molécule est un assemblage d'au moins deux atomes, unis par des liaisons chimiques.
4.2 Molécules du vivant
- Molécules inorganiques :
- Eau
- Sels minéraux
- Molécules organiques :
- Glucides
- Lipides
- Protéines
- Acides nucléiques
4.3 Liaisons chimiques
- 3 liaisons chimiques :
- Liaison ionique :
- Echange d'électrons entre les atomes qui forme des particules appelées ions (particules chargées électriquement
- Ion : atome qui gagne ou perd un ou plusieurs électrons
- Anion : atome qui gagne un ou plusieurs électrons, chargé négativement
- Cation : atome qui perd un ou plusieurs électrons, chargé positivement
- Liaison covalente :
- 2 atomes partagent deux électrons
- Liaison hydrogène :
- Interaction qui s'établit entre un atome d'hydogène lié par une liaison covalente à un atome électronégatif, et un autre atome électronégatif
5. Réactions chimiques
5.1 Définition
- Une réaction chimique est la transformation de substances chimiques en d'autres substances chimiques, qui implique une modification des liaisons chimiques
5.3 Equation chimique
- L'équation chimique est une représentation d'une réaction chimique :
- Réactifs + Réactifs -> Produits
- Exemple du chlorure de sodium :
- Sodium + Chlore -> Chlorure de sodium
- Na + Cl -> NaCl
5.3 Classification des réactions chimiques
- 3 principaux types de réactions chimiques :
- Réaction de synthèse
- Réaction de dégradation
- Réactions d'échange
- Réaction de synthèse :
- Deux ou plusieurs atomes ou molécules se combinent pour former une nouvelle molécule
- A + B -> AB
- Réaction de dégradation :
- Une molécule se sépare en deux ou plusieurs atomes ou molécules
- AB -> A + B
- Réaction d'échange :
- Deux ou plusieurs atomes ou molécules échange leurs composants
- AB + CD -> AC + BD
- Numéro atomique :
- Nombre de protons du noyau de l'atome
- Noté Z
- Nombre de masse :
- Somme des masses des protons et des neutrons du noyau
- Noté A
- Masse atomique :
- Moyenne des masses relatives de tous les isotopes (atomes dont le nombre de protons est identique mais dont le nombre des neutrons est différent) d'un élément
- A : nombre de masse (protons + neutrons)
- Z : numéro atomique (protons)
- X : symbole de l'élément
- 168O
- 65 % de la masse corporelle
- 126C
- 18 % de la masse corporelle
- 11H
- 10 % de la masse corporelle
- 147N
- 3 % de la masse corporelle
- 40,120Ca
- 1,5 % de la masse corporelle
- 3115P
- 1 % de la masse corporelle
- 39,119K
- 0,4 % de la masse corporelle
- 32,116S
- 0,3 % de la masse corporelle
- 2311Na
- 0,2 % de la masse corporelle
- 35,517Cl
- 0,2 % de la masse corporelle
- 24,312Mg
- 0,1 % de la masse corporelle
- 126,953I
- 0,1 % de la masse corporelle
- 55,826Fe
- 0,1 % de la masse corporelle
- 63,529Cu
- < 0,01 % de la masse corporelle
- 65,430Zn
- < 0,01 % de la masse corporelle
- 7934Se
- < 0,01 % de la masse corporelle
- 95,942Mo
- < 0,01 % de la masse corporelle
- 199F
- < 0,01 % de la masse corporelle
- AZMn
- < 0,01 % de la masse corporelle
- 54,925Co
- < 0,01 % de la masse corporelle
- 6,93Li
- < 0,01 % de la masse corporelle
- 28,114Si
- < 0,01 % de la masse corporelle
- 5224Cr
- < 0,01 % de la masse corporelle
Une molécule est un assemblage d'au moins deux atomes, unis par des liaisons chimiques.
- Eau
- Sels minéraux
- Glucides
- Lipides
- Protéines
- Acides nucléiques
- Liaison ionique :
- Echange d'électrons entre les atomes qui forme des particules appelées ions (particules chargées électriquement
- Ion : atome qui gagne ou perd un ou plusieurs électrons
- Anion : atome qui gagne un ou plusieurs électrons, chargé négativement
- Cation : atome qui perd un ou plusieurs électrons, chargé positivement
- Echange d'électrons entre les atomes qui forme des particules appelées ions (particules chargées électriquement
- Liaison covalente :
- 2 atomes partagent deux électrons
- Liaison hydrogène :
- Interaction qui s'établit entre un atome d'hydogène lié par une liaison covalente à un atome électronégatif, et un autre atome électronégatif
- Réactifs + Réactifs -> Produits
- Sodium + Chlore -> Chlorure de sodium
- Na + Cl -> NaCl
- Réaction de synthèse
- Réaction de dégradation
- Réactions d'échange
- Deux ou plusieurs atomes ou molécules se combinent pour former une nouvelle molécule
- A + B -> AB
- Une molécule se sépare en deux ou plusieurs atomes ou molécules
- AB -> A + B
- Deux ou plusieurs atomes ou molécules échange leurs composants
- AB + CD -> AC + BD
Rédaction
Rédaction Espacesoignant.com
Référence
- Dictionnaire médical de l’Académie de Médecine [Internet]. Paris: Académie nationale de médecine; 2019. Atome. [cité 05 octobre 2019]. Disponible sur: http://dictionnaire.academie-medecine.fr/index.php?q=atome
- Dictionnaire médical de l’Académie de Médecine [Internet]. Paris: Académie nationale de médecine; 2019. Molécule. [cité 05 octobre 2019]. Disponible sur: http://dictionnaire.academie-medecine.fr/index.php?q=molecule
Illustration